
Next: About this document ...
Up: test7
Previous: test7
- Nie jest prawdą, że w metodzie orbitali molekularnych MO zakładamy:
- funkcję falową w postaci antysymetryzowanego iloczynu
jednoelektronowych funkcji
- każdy elektron porusza się w uśrednionym potencjale pozostałych
elektronów
- każdy elektron opisany jest dwuelektronową funkcją zwaną orbitalem
- jądra są nieskończenie ciężkie
- Elektronowa funkcja falowa zamkniętopowłokowej molekuły w metodzie LCAO
MO:
- jest kombinacją liniową orbitali atomowych
- jest kombinacją liniową wyznaczników Slatera zbudowanych z
orbitali atomowych
- jest wyznacznikiem Slatera zbudowanym z dowolnych spinorbitali (iloczyn
orbitalu molekularnego i funkcji spinowej)
- jest wyznacznikiem Slatera zbudowanym ze spinorbitali (iloczyn
orbitalu molekularnego w postaci kombinacji liniowej orbitali atomowych
i funkcji spinowej)
- Dla metody CI (oddziaływania konfiguracji) nie jest prawdą:
- CI jest metodą wariacyjną
- nie uwzględnia korelacji elektronowej
- pojęcie konfiguracji elektronowej traci sens
- funkcję przedstawiamy jako liniową kombinację wyznaczników Slatera
utworzonych z orbitali obsadzonych i wirtualnych
- Całka rezonansowa H
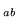 w cząsteczce H
w cząsteczce H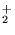 :
:
- da sie oszacować jako E
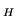 (energia atomu H)
(energia atomu H)
- jest pomijalnie mała (w stosunku do H
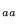 )
)
- przyjmuje tylko wartości ujemne
- zbiega do
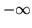 dla nieskończonej odległości pomiędzy jądrami
dla nieskończonej odległości pomiędzy jądrami
- Orbital
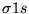 różni się od orbitalu
różni się od orbitalu 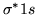 :
:
- energią
- wartością gęstości w połowie odległości pomiędzy jądrami
- rozkładem ładunku wokół obu jąder
- wszystkimi powyższymi
- Konfiguracja dla molekuły O
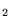 to:
to:
- (
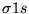 )
) (
(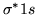 )
) (
(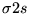 )
) (
(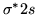 )
) (
(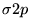 )
) (
(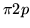 )
)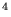 (
(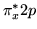 )
(
)
(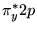 )
)
- (
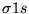 )
) (
(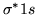 )
) (
(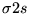 )
) (
(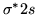 )
) (
(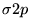 )
) (
(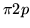 )
)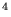 (
(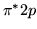 )
)
- (
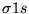 )
) (
(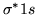 )
) (
(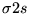 )
) (
(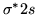 )
) (
(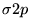 )
) (
(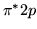 )
)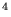 (
(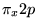 )
(
)
(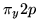 )
)
- (
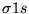 )
) (
(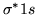 )
) (
(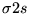 )
) (
(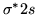 )
) (
(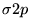 )
) (
(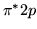 )
)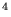 (
(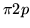 )
)
- W przybliżeniu LCAO MO nietrwała jest molekuła:
- He
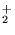
- He
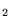
- Li
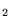
- Li
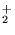
- W przybliżeniu LCAO MO prawdą jest:
- wiązanie w H
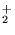 jest krótsze niż w H
jest krótsze niż w H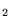
- stan podstawowy N
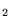 jest singletem
jest singletem
- O
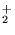 ma słabsze wiązanie niż O
ma słabsze wiązanie niż O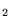
- wiązanie dwuelektronowe jest słabsze niż jednoelektronowe


Next: About this document ...
Up: test7
Previous: test7
Edyta Malolepsza
2000-12-15
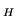 (energia atomu H)
(energia atomu H)
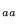 )
)
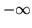 dla nieskończonej odległości pomiędzy jądrami
dla nieskończonej odległości pomiędzy jądrami
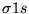 )
) (
(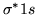 )
) (
(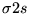 )
) (
(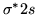 )
) (
(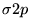 )
) (
(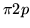 )
)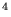 (
(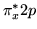 )
(
)
(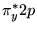 )
)
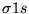 )
) (
(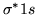 )
) (
(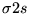 )
) (
(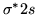 )
) (
(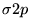 )
) (
(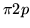 )
)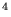 (
(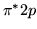 )
)
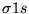 )
) (
(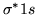 )
) (
(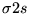 )
) (
(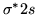 )
) (
(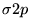 )
) (
(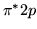 )
)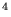 (
(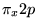 )
(
)
(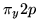 )
)
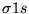 )
) (
(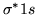 )
) (
(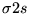 )
) (
(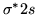 )
) (
(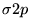 )
) (
(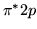 )
)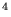 (
(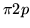 )
)
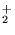
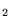
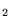
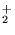
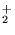 jest krótsze niż w H
jest krótsze niż w H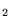
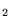 jest singletem
jest singletem
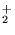 ma słabsze wiązanie niż O
ma słabsze wiązanie niż O