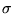- Prawdą jest, że:
- metoda MO dobrze opisuje dysocjację molekuły
- metoda VB dobrze opisuje układy wieloelektronowe
- wiązanie w molekule H
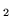 nie jest czysto kowalencyjne
nie jest czysto kowalencyjne
- orbital molekularny
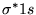 nie ma płaszczyzny węzłowej
nie ma płaszczyzny węzłowej
- Która molekuła ma najsilniejsze wiązanie:
- H
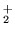
- H
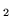
- H
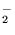
- H
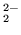
- Prawdą jest, że:
- efekt antywiążący jest silniejszy niż wiążący
- wiązaniem pojedynczym nazywamy wiązanie utworzone przez jeden
elektron znajdujący się na orbitalu
- odpychanie powłok walencyjnych nazywamy odpychaniem
walencyjnym
- elektrony walencyjne w molekule tlenu tworzą wiązanie takie
jak w etylenie (
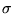 i
i 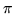 )
)
- Nie jest prawdą, że w metodzie wiązań walencyjnych VB dla cząsteczki
wodoru:
- potrafimy oszacować udział struktury kowalencyjnej H-H
- nie uwzględniamy faktu znalezienia obu elektronów przy jednym
jądrze
- funkcja falowa jest kombinacją struktur: H-H, H
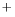 H
H ,
H
,
H H
H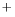
- żadna ze struktur z punktu c nie odpowiada rzeczywistości
- Metoda Hückla może być wykorzystana do obliczeń dla:
- płaskiej cząsteczki BCl
- cząsteczki 1,4-pentadienu
- molekuły benzenu
- wody pod warunkiem, że przyjmiemy kąt między atomami
HOH równy 120 stopni
- Lokalizacja orbitali:
- pozwala przyporządkować gęstość elektronową
poszczególnym wiązaniom, wolnym parom i rdzeniom atomowym
- zmniejsza odpychanie między elektronami
- pozwala na hybrydyzację orbitali
- nie zmienia funkcji falowej, ale obniża energię
- W metodzie Hückla:
- zaniedbujemy oddziaływanie elektronów
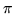 z elektronami
z elektronami
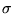
- rozpatrujemy tylko te elektrony
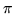 , które nie oddziałują ze
sobą
, które nie oddziałują ze
sobą
- zakładamy, że elektrony
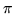 poruszają sie w pewnym
potencjale pochodzącym od jąder i elektronów
poruszają sie w pewnym
potencjale pochodzącym od jąder i elektronów 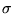
- funkcja falowa jest tworzona ze wszystkich orbitali
atomowych pochodzących od atomów węgla
- W przybliżeniu LCAO MO konfiguracja elektronowa N
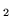 to:
to:
Edyta Malolepsza
2000-12-15
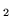 nie jest czysto kowalencyjne
nie jest czysto kowalencyjne
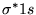 nie ma płaszczyzny węzłowej
nie ma płaszczyzny węzłowej
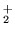
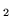
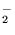
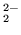
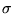 i
i 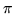 )
)
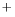 H
H ,
H
,
H H
H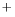
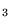
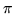 z elektronami
z elektronami
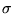
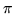 , które nie oddziałują ze
sobą
, które nie oddziałują ze
sobą
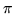 poruszają sie w pewnym
potencjale pochodzącym od jąder i elektronów
poruszają sie w pewnym
potencjale pochodzącym od jąder i elektronów